CAR-T之前世今生(下)-2
2018-05-22
三、CAR-T之后(post CAR-T)
历尽千辛万苦之后,一部分患者会获得一个比较理想的结果,对于B淋母,诺华的Kymriah报告的数据是:缓解率为82.5%,第三个月完全缓解率为63.5%,第十二个月完全缓解率维持在46%;对于淋巴瘤,Kite的Yescarta报告的数据是:缓解率为82%,完全缓解率为54%,第六个月完全缓解率维持在36%。
在国内,最近武汉同济报告的序贯回输包含CD28和4-1BB双共刺激分子的第三代CD22-CAR-T和CD19-CAR-T细胞的试验,B淋母缓解率高于80%,6个月的OS和EFS分别为80%和60%,12个月的OS和EFS分别接近60%和40%;淋巴瘤缓解率高于50%,6个月的OS和EFS分别约为90%和60%。数据基本符合预期,与国外同类试验在同一水平上。
由此可见,CAR-T治疗B淋母的缓解率非常高,但是可持续性还是不够理想,只有不到一半的患者能够维持较长时间的缓解。而淋巴瘤的情况就更差一些,大约有三分之二的患者不能缓解或缓解后复发。考虑到两类患者观察的时间都不长,后面复发的比例一定还会增加,所以,对于CAR-T来说,复发仍然是最大的问题,这也是所有癌症治疗所面临的最大问题。
对于癌症患者来说,主要追求的是两点,第一是生存期(OS),第二是生存质量(QoL)。很多时候,为了OS,可以暂且不顾QoL,只考虑OS。医生不可能随访患者一辈子,OS通常需要用其它指标来替代,比如说PFS(无进展生存),而PFS的前提是CR(完全缓解)。最理想的情况是CR->PFS->OS,即获得完全缓解后,缓解可以持续,然后获得长期生存,也就是说“治愈”,但实际情况并非如此,特别是对于那些不得不去做CAR-T的复发难治的白血病/淋巴瘤患者来说,这几个指标之间的转化率都不高,真正从CAR-T治疗中获得OS上的收益的比例目前还相当低,所以,即使获得了CR,也只是完成了第一步,后面怎么办,这个问题相当重要。
对于B淋母这样的白血病来说,答案可能相对来说明确一些。首先我们有很好的预后判断模型,用常规细胞遗传学检查和FISH可以分辨出那些预后很差的患者,其次有敏感度极高的方法比如说流式细胞术和PCR技术检查MRD(微小残留病变),10,000个细胞中有一个坏细胞就可以检查出来。所以,CAR-T之后,对于复发风险极高的B淋母,包括那些虽然细胞遗传学上没有特别情况但是CAR-T之后仍然MRD阳性(定义为骨髓和/或外周血肿瘤细胞大于0.01%)的患者,在有合适配型的前提下,考虑做异体干细胞移植。不过,最近有一项小样本的回顾性临床研究表明,即使是异体干细胞移植也未能改善CAR-T前肿瘤负荷大的患者临床结局,无论在CAR-T后存在MRD疾病(骨髓中白血病细胞<5%)还是存在形态学疾病(骨髓中白血病细胞>5%),所以,或许MRD疾病的患者可以再观察一下而不急于去做异体干细胞移植。
而对于淋巴瘤来说,情况可就复杂多了。到底哪些人会复发,相信绝大多数医生心里都没底,也没有合适的技术检查MRD,虽然这两年liquid biopsy的研究有些进展,但还远达不到可以信赖的程度。到目前为止,国内外经CAR-T治疗后维持完全缓解状态的弥漫大B患者观察时间最长的也就是两年多吧,是不是治愈了真的很难说,而且这样的患者的比例不太高,多数人要么没能完全缓解,要么缓解后复发。与B淋母不同的是,淋巴瘤的患者相对来说年纪偏大,身体状况偏差,适合于做异体干细胞移植的不多。所以,解决问题的关键还是在于提高CAR-T的缓解率和可持续性。也就是说,对于B淋母,我们也许可以简单粗爆一些,用CAR-T来为异体干细胞移植创造条件,把它当作是一种“桥接”的技术,而对于淋巴瘤,我们需要精益求精,让CAR-T本身发挥最大作用,而把移植放在更加次要的位置。
那么,都有哪些办法来提高CAR-T的缓解率和可持续性呢?除了CAR-T技术本身的优化之外,未来的方向是与其它药物联合,比如说,与伊布替尼和PD-1单抗联合。在针对慢淋的初步的CAR-T试验中发现,之前经过伊布替尼治疗的患者的缓解率高于未经伊布替尼治疗的患者,大致的原因可能是虽然伊布替尼本身消灭肿瘤细胞的能力不强,但是却可以很高效的把淋巴结里面的肿瘤细胞“赶”到外周血中,使其直接面对CAR-T细胞的围剿。不过,这个作用机制在弥漫大B上是否同样适用还不清楚。PD-1单抗的使用也有充分的理论依据,在免疫反应后期,T细胞表面会表达PD-1,而周边肿瘤细胞和间质细胞会表达PD-L1和PD-L2,PD-1与PD-L1和PD-L2结合后T细胞就会衰竭,失去杀死肿瘤细胞的能力。实际上,诺华提交给FDA的Kymriah的数据中就包含了一部分PD-1单抗的使用,只不过数据量远还不足以支持FDA批准将PD-1单抗与CAR-T联合使用,而且,联合用药风险还是相当大的,CAR-T本身的不良反应就已经让医生们手忙脚乱了,在加上一个PD-1单抗,好比是火上浇油,没有很长时间的探索和优化,实在不敢轻易的使用。
在所有手段都用了之后,可能还要面临移植还是不移植的问题。
先说自体干细胞移植。目前国外在CAR-T治疗后是不做自体干细胞移植的,要移植就是异体干细胞移植。原因有二:首先,参加CAR-T试验的患者都是多重耐药因而根本无法进行自体干细胞移植的,CAR-T之后如果有残留病变,不可能期望原先已经耐药的肿瘤细胞在CAR-T之后又重新变得对化疗敏感,这在理论上是说不通的;其次CAR-T之后是期望CAR-T细胞能够在体内长期存留的,自体干细胞移植的大化疗会摧毁所有CAR-T细胞,使这个梦想破灭。但在国内某些医院有把自体干细胞移植与CAR-T结合的试验,可能也是无奈之举。
这是国内某生物公司CAR-T细胞在体内存留的情况,可以看出,一百天之后基本上趋于零了,在这个前提下还期望CAR-T细胞在体内保持一个长期的免疫监视的作用恐怕不现实,在复发的风险很大的情况下,如果异体干细胞移植又因为各种原因不宜实施,自体干细胞移植可能是一个可行的选择。
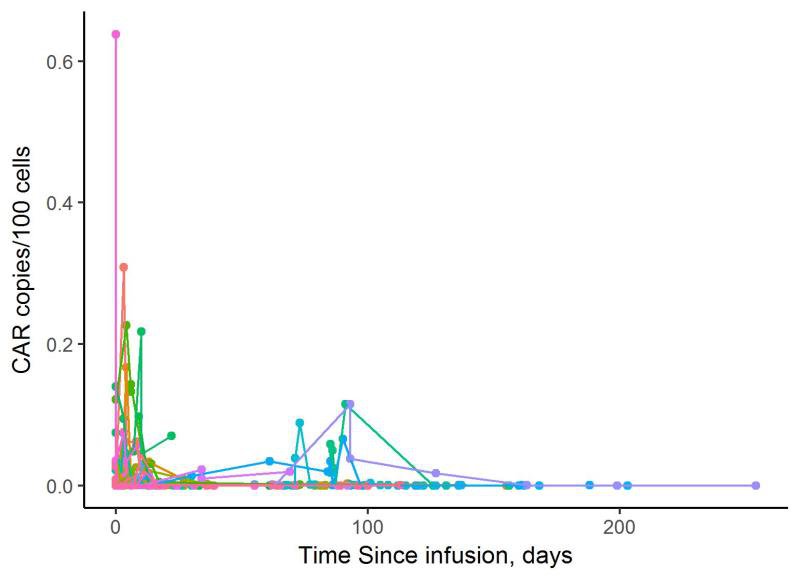
图四 CAR-T细胞在体内存留的时间
国内也有医院在尝试“自体干细胞移植+CAR-T”,或者“CAR-T+自体干细胞+CAR-T”,这种做法似乎是把CAR-T降格为一种用于清除MRD的东西,类似于国内曾经非常流行的DC-CIK,这在理论上是存在一点疑问的,CAR-T在体内的扩增和充分的活化与抗原的数量有直接关系,当肿瘤负荷已经小到接近MRD的水平的时候,CAR-T是否还能够发挥预期的作用?这只能等试验的数据出来后才知道。
再说异体干细胞移植。如果是预后非常不好的类型,例如双重或者三重打击,或者CAR-T后也只是部分缓解,再比如患者非常年轻,又有很好的配型,异体干细胞移植可以说是一个很合理的选择。国外也有倒过来做的,即先进行异体干细胞移植,然后再CAR-T,这时候患者的T细胞其实是由供者的骨髓造血干细胞分化而来的,一方面不存在的某些先天的T细胞缺陷,另一方面也不会有因多重化疗造成的T细胞的后天伤害,所以这样的T细胞非常健康,转染成CAR-T细胞后战斗力会比患者自己的更强。从个例的报道来看,效果很好,有一例中枢神经系统侵犯的患者,在异体干细胞移植+CAR-T后再次出现中枢神经系统复发,但是后来不治而愈,大概是体内还存留的CAR-T细胞重新被激活,将肿瘤扼杀于萌芽状态。如果打算这么做的话,因为不特别依赖大剂量化疗来清除肿瘤细胞,所以在移植时可以考虑用非清髓性的预处理方案,把移植相关死亡率从~25%降到~15%,使得风险获益比处于可接受的范围。不过,如果肿瘤负荷太大,或者侵袭性过强,这种方法恐怕不适用。
另外,也有干脆就用异体T细胞的CAR-T,例如法国Cellectis公司直接将来源于非患者供体的T细胞进行修饰,用于多个患者的治疗。这种方法一旦成功,会比自体细胞的CAR-T有巨大的优势,可以使CAR-T细胞的生产完全工业化,做出来的是标准化的产品,不需要很麻烦的每次提取患者自己的T细胞再送去处理了,CAR-T细胞是off the shelf的,拿来就用,像滴注美罗华一样简单。不过,前些日子在临床试验中一位树突状细胞肿瘤的患者在CAR-T回输后第9天因为严重的CRS死亡,结果Cellectis的两项试验都暂时被FDA给叫停了。所以,参加CAR-T试验的风险是真实存在的。
还有一种提高CAR-T缓解率和可持续性的办法可能会有点让人意想不到,那就是将其前移,从最后一线、第四线、第三线逐渐前移到比如说第二线治疗。绝大多数医院都是和生物公司合作搞CAR-T的,两者之间产生过不少矛盾。当CAR-T效果不好时,临床医生也很苦恼,难免会埋怨生物公司的代表:老弟,你们给我们提供的是神马东西啊,怎么一点效果也没有,你确信转染率不是0?CAR细胞阳性率不是0?而生物公司的代表也很委屈:大哥,您也不看看您给我们挑选的都是神马病人啊,几乎个个都只剩半口气了,就是神仙来了也没什么办法,下次能让基础状况好一点、T细胞没有经过二十几次化疗摧残的病人来试试我们家的CAR-T吗?解决这个矛盾,需要双方的努力,生物公司要致力于提高CAR-T安全性,临床医生要积累经验更高效的处理CAR-T的副作用,只有当安全性有保障的时候,才有可能逐渐的将CAR-T前移,前移后或许可以看到更好的效果。当安全性还存在疑问的时候,医生是绝不敢轻易上CAR-T的,因为自古以来全世界行医者的信条都是:First,Do No Harm(首先,不要伤害)。
最后,说一下国内的临床试验。严格的说,目前国内的CAR-T试验都是在“抢跑”,都不是在官方的“药物临床试验登记与信息公示平台”正式注册的可用于新药申报的临床试验,因为CFDA关于将CAR-T作为药品申报的政策性文件《细胞制品研究与评价技术指导原则》还没有正式出台,连原则还没有定下来,怎么可能批准这样的临床试验。所以,目前国内所有CAR-T临床试验,充其量算是pilot study,其数据无论如何出色,将来都无法用于新药申报。不过,这个情况很快就会有改变,CFDA已经宣布有关文件将在年内正式发布,而且CFDA已经接受了国内第一家CAR-T临床试验的申请,这好比闸门已经打开,就要放水啦,相信后面CAR-T试验的申请会像潮水一样涌来。这对有意参加试验的病友来说是一个有喜有忧的事情,喜的是选择会非常多,忧的是选择太多了,反而不知该如何选择。这里简单提示两点,第一,注意生物公司的资质。上篇说过,国际上CAR-T技术领先的有诺华、Kite和Juno,另外还有一家Bluebird Bio(蓝鸟)。目前,诺华在华没有动静,而凯特与复兴药业成立了合资公司叫做复兴凯特,朱诺和药明康德成立了合资公司叫做药明巨诺,如果他们在国内开展临床试验,应该属于第一集团的,比较靠谱。可以列在第二集团的,那就太多了,有西比曼(301技术)、波睿达(武汉张同存技术)、科济生物(专注实体瘤)、斯丹赛(起步较早)、优卡迪(据称与宾大Carl June团队有合作)、南京传奇(前面说的国内第一个申报的就是它,以BCMA为靶点治疗多发性骨髓瘤获得100%客观缓解率,比Bluebird Bio的数据还好)、恒润达生、北京马力喏生物、北京艺妙神州、吉凯基因等等,其它还有很多,就不一一开列了,总之这些公司主要集中在北京和上海的周边,尤其以上海居多。第二点注意的就是医院,一般来说知名三甲医院会选择比较靠谱的生物公司来合作,而且,在CAR-T实施过程中医生的经验和水平也非常重要,所以,如果不知如何选择生物公司,就选医院吧。另外,公立三甲医院操作比较规范,在目前阶段基本不收费,即不收与细胞制备直接相关的费用,而一些民营医院偷偷的把CAR-T试验当作是已经成熟的医疗技术来做,在收费上一分不少,这就有些不地道了。
未来,单说CAR-T疗法恐怕就不够全面了,因为有的公司已经开始研究CAR-NK,即用NK细胞替代T细胞,而且是异体的NK细胞,这在某些方面比CAR-T更有优势。还有,除了B细胞淋巴瘤和白血病以外,T细胞淋巴瘤以及髓系白血病也快要看到希望了,有的CAR-T选择CD7为靶点,面向T淋母的患者,有的CAR-T以CD123为靶点,面向急性髓系白血病患者。比如说,前几天传来消息,位于美国南加州的医疗中心City of Hope用以CD123为靶点的CAR-T疗法让一位BPDCN(母细胞性浆细胞样树突状细胞肿瘤)患者获得了完全缓解,引起了一个不小的轰动。这个论坛上也曾经有过几位BPDCN患者,这下他们也有了更多的选择,因为国内也有公司在做这样的试验。
至此,我们关于CAR-T介绍就将告一段落,但我相信,CAR-T的故事还远未结束。作为一个目前只能用于三线或者说最后一线的技术,将来一定会往二线甚至一线前移。或许有一天,白血病/淋巴瘤以及其它恶性肿瘤的患者,只需做一个疗程简单的debulking的化疗,然后就可以去做CAR-T,让免疫系统重新掌握主动而实现对疾病持久的控制。希望这一天能早点到来!
——摘自《淋巴瘤之家》
